Bioquímica/Catálisis
<< Bioquímica | << Termodinámica | Catálisis | Metabolismo y energía >>
Introducción
[editar]Catálisis se refiere a la aceleración de la tasa de un reacción química mediante una sustancia, llamada catalizador, que no es modificada por la reacción. La catálisis es crucial para cualquier forma de vida, ya que hace que las reacciones químicas ocurran mucho más rápido, a veces por un factor de varios millones de veces más de lo que lo harían "por sí mismas".
Un error muy común es creer que el catalizador "permite que la reacción ocurra", que la reacción no se daría sin la presencia de dicho catalizador. Sin embargo, un catalizador no puede hacer que una reacción termodinámicamente desfavorable proceda. Más bien, solamente puede acelerar la reacción que es termodinámicamente favorable. La reacción puede proceder en ausencia del catalizador aunque quizás lentamente como para ser observada desde la práctica.
Los catalizadores aceleran las reacciones químicas modificando el camino energético entre los reactivos y los productos. Usualmente, esto involucra un compuesto, un intermediario, el cual no puede formarse sin el catalizador. La barrera de la energía de activación necesaria para la formación de este intermediario es menor a la requerida por los reactivos para dar lugar a los productos en ausencia del catalizador.
La catálisis es un proceso muy importante desde el punto de vista de la industria, ya que la producción de la mayoría de los productos químicos requiere catálisis. La catálisis es un campo de investigación muy importante en la ciencia aplicada e involucra a muchos otros campos provenientes de la química y la física
Generalmente, se distinguen dos tipos de catalizadores. En la catálisis homogénea los reactivos y el catalizador están en la misma fase. Por ejemplo los ácidos (H+ dadores de protones) son catalizadores muy comunes en reacciones acuosas. En este caso tanto los reactivos como el catalizador están en la fase acuosa. En la catálisis heterogénea, el catalizador se encuentra en una fase diferente a los reactivos y los productos. Usualmente el catalizador es un sólido y los reactivos y productos son gases o líquidos. Para que la reacción ocurra uno o más de los reactivos debe difundir a la superficie del catalizador y adsorberse en ella. Luego de la reacción, los productos deben desadsorberse de la superficie y difundir fuera de la superficie sólida. Este transporte de reactivos y productos de una fase a la otra representa con frecuencia el paso limitante de la reacción. Comprender estos fenómenos de transporte es un área importante en el estudio de los catalizadores.
Enzimas
[editar]Enzima (del griego, fermento) son moléculas de proteínas particulares cuya función es facilitar o acelerar la mayoría de las reacciones químicas de la célula.
Dentro de la células biológicas ocurren muchas reacciones químicas que, sin la presencia de las enzimas, ocurririan a una tasa demasiado lenta para ser biológicamente relevantes.
Las enzimas pueden acoplar dos o más reacciones para que ocurran al mismo tiempo, de esta forma una reacción termodinámicamente favorable puede ser utilizada para "dirigir" una reacción desfavorable. Uno de los ejemplos más comunes son las enzimas que utilizan la desfosforilación del ATP para dirigir reacciones no relacionadas.
Para que las reacciones químicas ocurran es necesario que exista una cierta cantidad de energía de activación. Las enzimas pueden incrementar la velocidad de la reacción favoreciendo o habilitando una vía diferente de reacción con una energía de activación menor (Fig.1), haciendo mucho más fácil que la reacción ocurra. La enzimas son grandes proteínas globulares que catalizan (aceleran) reacciones químicas y son esenciales para las funciones celulares. Las enzimas son muy específicas para las reacciones que catalizan y los químicos (sustratos) que utilizan. Los sustratos se acomodan en su enzima de manera análoga a la que una llave calza en un cerradura (Fig.2). Muchas enzimas están compuestas de varias proteínas que actúan juntas como una unidad. La mayor mayor parte de una enzima tiene funciones regulatorias o estructurales. La reacción catalizada tiene lugar en una pequeña parte de la enzima llamada sitio activo, el cual es formado por aproximadamante 2 - 20 aminoácidos.

El sustrato (X) necesita una gran cantidad de energía (Ea X→Y) para alcanzar el estado intermediario, el cual reacciona para formar el producto final (Y). Las enzimas dismunyen la barrera de la energía de activación de tal manera que X pueden alcanzar más fácilmente el estado intermediario, reduciendo la cantidad de energía necesaria para superar la barrera de activación. Como resultado la velocidad de la reacción se incrementa al aumentar las probabilidades de que ocurra la reacción.

Las enzimas pueden realizar hasta varios millones de reacciones catalíticas por segundo. La velocidad máxima de una reacción enzimática se determina incrementando la concetración de su sustrato hasta que la tasa de formación de producto sea constante (Fig. 3). Esta se denomina la velocidad máxima (Vmax) de una enzima. En este estado, todos los sitios activos de todas las moléculas se encuentran saturados con sustrato. Esto fue propuesto por Leonor Michaelis y Maud Menten en 1913. En la figura 4 se ve un modelo de una reacción enzimática de sustrato único que responde a la cinética de Michaelis-Menten. A bajas concentraciones de [S] la enzima existe tanto en forma libre, E, como unida a S, ES. La tasa de reacción depende de la concentración de [ES] y de la la tasa k2, formalmente: ecuación 1
Cuando la concentración de S es muy alta la enzima se encuentra saturada, todas las moléculas se encuentran formando parte del complejo ES, entonces la tasa de reacción es insensible a los cambio en [S] y depende solo de k2. Formalmente: . Esta velocidad de reacción es máxima y se llama Vmax. A k2 se le llama constante de catálisis o Kcat (también llamada número de recambio por turnover number)que indica el número de reacciones por unidad de tiempo que realiza un sitio activo. Las unidades de Kcat son, usualmente, segundos-1. A concentraciones de S debajo de la saturación la tasa depende tanto de la unión del sustrato como de la tasa del paso catalítico. Sustituyendo la ecuación de equilibrio de la unión del sustrato en la ecuación 1 se obtiene la ecuación de Michaelis-Menten.
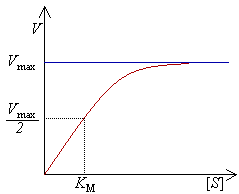
La velocidad V indica el número de reacciones por unidad de tiempo que son catalizadas por la enzima. A medida que se incrementa la concentración de sustrato [S], la reacción se aproxima asintóticamente a su velocidad máxima Vmax. Por ello no puede determinarse con precisión el valor de [S] para Vmax, en su lugar la constante característica de una enzima se define como la concentración de sustrato necesaria para obtener la mitad de la velocidad máxima (Vmax/2). Es valor es llamado de la constante de Michaelis-Menten simbolizada con KM.

Existen varios factores que influencian la velocidad de reacción, la actividad catalítica y la especifidad de una enzima. Los factores químicos del ambiente donde se encuentra la enzima tales como el pH y la temperatura afectan la tasa de reacción. Al adicionar más cantidad de enzima a una reacción, la velocidad de la misma se incrementa, es por ello que las células producen más proteína de una determinada enzima cuando es necesario incrementar la producción de un cierto metabolito. Más allá de la síntesis de novo de más moléculas de enzima para incrementar una reacción, la célula utiliza mecanismos más específicos para regular la actividad enzimática mediante modificaciones post-traduccionales (por ejemplo: fosforilación) de la enzima o adicionando cofactores tales como iones metálicos, o moléculas orgánicas (por ejemplo: NAD+, FAD, CoA, o vitaminas) que interactúan con la proteína.
Enzimas alostéricas
[editar]
El modelo de Michaelis-Menten ayudó mucho al desarrollo de la química de la enzimas gracias a su simplicidad y aplicabilidad. Sin embargo, este modelo no explica las propiedades cinéticas de muchas enzimas. Un grupo de enzimas que no obedecen la cinética de Michaelis-Menten son las enzimas alostéricas (Fig. 5), estas enzimas tienen varias subunidades y varios sitios activos.
En las enzimas alostéricas la unión de un sustrato a un sitio activo puede afectar las propiedades de otros sitios activos en la misma molécula. Un posible resultado de esta interacción entre subunidades es que la unión del sustrato resulte cooperativo, es decir que la unión del sustrato en un sitio activo facilita la unión de los otros sustratos en los sitios activos vecinos. Además la actividad de una enzima alostérica puede ser alterada por moléculas regulatorias que se unan de manera reversible sitios sobre la proteína que se encuentren en sitios diferentes al sitio activos. Así, las propiedades catalíticas de las enzimas alostéricas pueden ajustarse para cumplir con las demandas inmediatas de la célula. Debido a ello las enzimas alostéricas son los puntos clave de regulación de las vías metabólicas.
Inhibición Enzimática
[editar]La actividad de muchas enzimas puede ser inhibida por pequeñas moléculas específicas o iones. La inhibición de las enzimas es utilizada por la célula para controlar la actividad metabólica. La enzimas alostéricas son un punto de control muy utilizado y es habitual que varios metabolitos diferentes actuen sobre ellas, tanto inhibiendo como activando. Además muchas drogas y toxinas son inhibidores de enzimas claves para el metabolismo celular. En el estudio de los mecanismos de acción de las enzimas es muy útil contar con inhibidores específicos que permiten determinar cuales son las funciones donde actúa la enzima y/o los aminoácidos relevantes para su actividad catalítica.


Los inhibidores pueden actuar de manera reversible o irreversible. Un inhibidor irreversible (Fig. 6) se une fuertemente a la enzima de tal forma que el tiempo de disociación es muy largo, esto puede ocurrir tanto por uniones covalentes como no covalentes. Por otra lado los inhibidores reversibles (Fig. 7) se caracterizan por un rápida disocianción del complejo enzima-inhibidor. Los inhibidores reversibles se clasifican en competitivos o no competitivos de acuerdo a cómo afectan la cinética de la reacción.

Los inhibidores competitivos se unen a la enzima en el mismo sitio donde se une el sustratos compitiendo por el sitio activo (Fig. 8) ya que se "parecen" al sustrato. Se forma un complejo enzima-inhibidor (EI) no productivo secuestrando moléculas de enzima de la reacción (Fig. 7). El efecto neto que se observa es como si se "quitaran" moléculas de enzima de la reacción. Dada cualquier concentración de inhibidor la inhibición puede ser disminuida incrementando la concentración del sustrato.
Como se mencionó más arriba, las enzimas catalizan reacciones disminuyendo la barrera de activación energética de la misma. Para lograrlo estabilizan al estado de transición de la reacción, el cual se une fuertemente en el sitio activo. En 1948 Linus Pauling propuso que compuestos similares al estado de transición de la reacción serían buenos inhibidores. Estas moléculas miméticas son llamados análogos del estado de transición y se parecen al estado de transción pero de algún modo no son reactivos en el sitio activo de la enzima por lo que la reacción no puede proceder. Un ejemplo muy actual son los inhibidores de la neuraminidasa conocidos como las drogas antivirales contra el virus de la influenza. Estos compuestos son análogos del estado de transición de la reacción de hidrólisis del ácido neuramínico. Dicho estado de transición ocurre dentro del sitio activo durante el ciclo de catálisis.
<< Bioquímica | << Termodinámica | Catálisis | Metabolismo y energía >>

![{\displaystyle {\begin{matrix}v=k_{2}[ES]\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1da1731dd556ed99b2d424f500535524a8736cd)

![{\displaystyle v={\frac {V_{max}[S]}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7e6235eed395d2e7b07e8ea0f8101fa34c435f7)