Wikichicos/Los Elementos/Formando enlaces
Enlaces
[editar]
Los átomos son capaces de unirse entre sí para formar moléculas y compuestos. Un compuesto es una molécula con más de un tipo de elemento en ella. ¿Cómo lo hacen? Tiene que ver con sus electrones.
Enlaces iónicos
[editar]Cuando un átomo está solo antes de haber reaccionado con algo, tiene el mismo número de protones que de electrones. Con un número igual de protones y electrones, las cargas se anulan entre sí y el átomo no tiene ninguna carga.
A veces, los átomos no tienen un número igual de protones y electrones. Si un átomo pierde un electrón, significa que tiene más protones que electrones, y por lo tanto el átomo tiene una carga positiva. Si un átomo gana un electrón, significa que tiene más electrones que protones, y por lo tanto el átomo tiene una carga negativa. Los átomos con carga se llaman iones.
Para formar un enlace iónico, algunos átomos tomarán un electrón de otro átomo; esto hará que ambos sean iones, uno positivo y otro negativo. Debido a que uno es positivo y el otro negativo, los iones se atraerán entre sí y formarán un enlace iónico. Un enlace iónico es un enlace que se forma cuando un átomo toma el electrón o los electrones de otro átomo. La imagen de la derecha es una explicación del enlace entre el cloro y el sodio para formar cloruro sódico (sal común).
Enlaces covalentes
[editar]
No todos los enlaces se forman al dar o quitar electrones. Los átomos pueden compartir electrones en su lugar. Compartiendo los electrones, los átomos pueden unirse, pero no forman iones porque ninguno de los átomos perdió o ganó electrones.
Enlace covalente puro
[editar]Esto es cuando los dos átomos que forman el enlace comparten los electrones por igual.
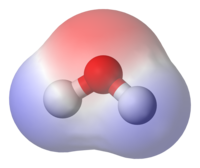
Todos los átomos pueden atraer electrones en un vínculo covalente puro. Algunos tienen un alto poder de atracción, como oxígeno, nitrógeno, cloro, y fluor. Algunos tienen un bajo poder de atracción como los metales, carbono, y hidrógeno. Se considera que los elementos con atracción idéntica o similar forman enlaces covalentes puros.
Enlace covalente polar
[editar]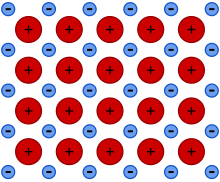
Esto implica un reparto desigual. Cuanto más a la derecha y arriba de la tabla periódica, mayor es el poder de atracción del elemento. Las excepciones a esto son los gases nobles. Si dos elementos tienen diferencias significativas en los poderes de atracción, el resultado es un Lazo Covalente Polar.
Enlaces metálicos
[editar]Una forma ligeramente diferente de compartir que puede pensarse en términos de átomos que están en un mar de electrones compartidos. Los enlaces metálicos sólo existen en los metales, como aluminio, oro, cobre, etc.
